Kyselina ortofosforečná и kyselina fosforečná jsou základní kyseliny fosforu často používané v průmyslu a jiných aplikacích. Tyto dvě sloučeniny mají různé struktury a vlastnosti, což určuje jejich jedinečné vlastnosti a aplikace.
Kyselina ortofosforečná, také známá jako kyselina fosforečná (V), má vzorec H3PO4. Jeho molekuly obsahují jeden atom fosforu, čtyři atomy kyslíku a tři atomy vodíku. Kyselina ortofosforečná se nazývá ortho-, protože je prvním (původním) prototypem řady kyselin fosforečných.
Kyselina fosforečná má vzorec H3PO3 a skládá se z jednoho atomu fosforu, tří atomů vodíku a tří atomů kyslíku. Struktura molekuly kyseliny fosforečné se liší od kyseliny ortofosforečné a jiných kyselin fosforečných. Na rozdíl od jiných kyselin fosforečných, které lze použít jako potravinářské přídatné látky (E338), není kyselina fosforečná ke konzumaci bezpečná a může být jedovatá.
Popis kyseliny fosforečné
Kyselina ortofosforečná – bezbarvá krystalická látka, která je široce používána v chemickém průmyslu. Má vzorec H3PO4 a molární hmotnost 97,99 g/mol.
Získává se z fosforečnanu amonného nebo fosforečnanu vápenatého úpravou kyselinou sírovou. Čistá kyselina fosforečná se prakticky nikdy nepoužívá v čisté formě, protože je velmi agresivní vůči mnoha materiálům, včetně mnoha kovů a plastů.
Kyselina fosforečná se používá v různých průmyslových odvětvích. Používá se například k výrobě hnojiv jako jsou superfosfáty a v laboratorní diagnostice k testování obsahu kovů v materiálech.
- Jednou z hlavních vlastností kyseliny ortofosforečné je její tepelná stabilita;
- Další důležitou vlastností je jeho snadná rozpustnost ve vodě;
- Kyselina ortofosforečná je středně silná kyselina a tvoří orthofosfátové soli.
Kyselina ortofosforečná je jednou z kyselin obsahujících dusík. Od kyseliny fosforečné se liší tím, že je méně kyselé povahy, protože má v molekule tři atomy kyslíku.
Navzdory některým svým nevýhodám je tedy kyselina fosforečná důležitou chemickou látkou s četnými průmyslovými a vědeckými aplikacemi.
Popis kyseliny fosforečné
Kyselina fosforečná je bezbarvá kapalina se silně kyselou chutí a vůní. Jeho vzorec je H3PO4. Kyselina fosforečná je triprotická kyselina, což znamená, že její molekula obsahuje tři kyselé skupiny.
V přírodě se kyselina fosforečná vyskytuje ve formě metabolitů v živých organismech. Tato kyselina je také široce používána v různých průmyslových odvětvích, včetně hnojiv, detergentů, výroby potravin a nápojů.
Kyselina fosforečná je jedním z nejsilnějších oxidačních činidel, které je široce používáno v laboratořích. Používá se k oxidaci mnoha organických látek. Kyselina fosforečná má navíc dezinfekční vlastnosti a používá se k likvidaci bakterií a virů.
Při používání kyseliny fosforečné je třeba dbát opatrnosti, protože je zdraví nebezpečná a při vdechnutí může způsobit popáleniny kůže a poškodit plíce.
Kyselina fosforečná je navíc důležitá pro živé organismy. Hraje klíčovou roli v metabolismu zvířat a rostlin a je také nezbytným prvkem v procesu štěpení tuků a sacharidů k výrobě energie v buňkách organismů.
Celkově je kyselina fosforečná důležitým prvkem v přírodě a průmyslu, který má pozitivní i negativní účinky na živé organismy.
Srovnávací analýza kyselin
Kyselina ortofosforečná:
- Chemický vzorec: H3PO4
- Molární hmotnost: 98 g / mol
- Vzniká zahříváním fosforečnanu vápenatého s kyselinou sírovou
- Má silné kyselé vlastnosti a při kontaktu může způsobit podráždění pokožky a sliznic
- Často se používá při výrobě hnojiv, farmacii, potravinářském průmyslu
Kyselina fosforečná:
- Chemický vzorec: H4P2O7
- Molární hmotnost: 177.97 g / mol
- Vzniká při zahřívání fosforečnanu amonného
- Má slabé kyselé vlastnosti a používá se jako různé sloučeniny fosforu při výrobě keramiky, skla, fotochemie atd.
- Nezpůsobuje podráždění při kontaktu s kůží a sliznicemi
Kyselina ortofosforečná a kyselina fosforečná mají své vlastní charakteristiky, jejich vlastnosti závisí na jejich chemické struktuře a způsobu výroby. Výběr jedné z těchto kyselin závisí na povaze a účelu aplikace a také na požadavcích na ně ve fázi výroby a práce s nimi.
KYSELINA FOSFOREČNÁ (kyselina ortofosforečná) H 3 PO 4, mol. m. 97,995; bezbarvý hygroskopické krystaly monoklinického systému (a = 0,5762 nm, b = 0,4831 nm, c = 1,1569 nm, = 95,31°, mezery, gr. P21/c); rozostření ve vzduchu; t.t. 42,50 °C; hustý 1,88 g/cm3; -1283 kJ/mol; max. stabilní připojení v řadě fosfor obsahující kyslík. V roztaveném stavu je náchylný k podchlazení; při 15 0 C tvoří hustou olejovitou kapalinu, při -121 0 C tvoří sklovitou hmotu.
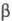
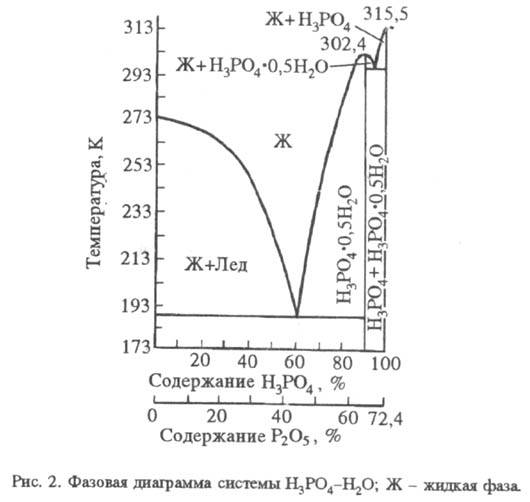
Kyselina fosforečná se mísí s vodou v libovolném poměru. Razb. vodné roztoky mají kyselou chuť. Z vysoké koncentrace roztoky krystalizují ve formě hemihydrátu (hemihydrátu) H 3 PO 4 ·0,5H 2 O- bezbarvý. monoklinické krystaly (a = 0,7922 nm, b = 1,2987 nm, c = 0,7470 nm, = 109,9°; mezera, gr. P21/a). Molekula bezvodé H 3 PO 4 a její krystalický hydrát obsahuje tetraedr. skupina PO 4. V bezvodé kyselině fosforečné vznikají vodíkové vazby typu P – O – H. O = P (obr. 1) (vzdálenost mezi atomy O je 0,253 nm), které drží struktury PO 4 ve formě vrstev rovnoběžných s jednou z rovin krystalu. Na konci zůstávají vodíkové vazby. (70-80%) roztok kyseliny fosforečné, což částečně určuje jeho sirupovitý charakter. V sekci do 40-50 % pH je zaznamenána stabilnější vodíková vazba fosfátových aniontů s molekulami vody, a nikoli s jinými fosfátovými anionty. V roztocích kyseliny fosforečné dochází k výměně atomů kyslíku mezi skupinami PO 4 a vodou.
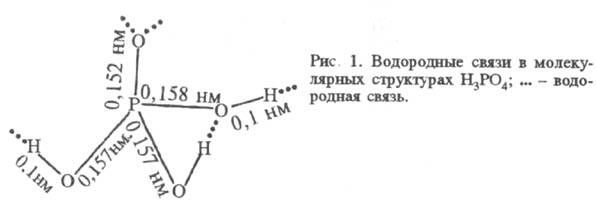
H 3 PO 4 – silná, K 1 7,1 10 -3 (pK a 2,12), K 2 6,2 10 -8 (pK a 7,20), K 3 5,0 10 -13 (pK a 12,32); hodnoty K 1 a K 2 závisí na teplotě. Disociace v prvním kroku je exotermická, ve druhém a třetím endotermická. Fázový diagram systému H 3 PO 4 – H 2 O je na Obr. 2. Maximum krystalizační křivky je při teplotě 302,4 K a obsahu H 3 PO 4 91,6 % (pevná fáze – hemihydrát). V tabulce Jsou uvedeny vlastnosti roztoků kyseliny fosforečné.
CHARAKTERISTIKA VODNÝCH ROZTOKŮ H 3 PO 4
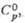
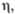
Ud. elektrický vodivost, S/m (25 0 C)
Kyselina fosforečná je za normálních podmínek neaktivní a reaguje pouze s uhličitany, hydroxidy a některými kovy. V tomto případě vznikají jedno-, dvou- a trojsubstituované fosfáty (viz Anorganické fosfáty). Při zahřátí nad 80 0 C reaguje i s neaktivními oxidy, oxidem křemičitým a silikáty. Při zvýšených teplotách je kyselina fosforečná slabým oxidačním činidlem pro kovy. Při působení na kov. Povrch roztoku kyseliny fosforečné s přísadami Zn nebo Mn tvoří ochranný film (fosfátování). Kyselina fosforečná při zahřátí. ztrácí vodu tvorbou postupně pyro- a metafosforových sloučenin:
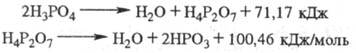
Phospholeum (kapalný anhydrid kyseliny fosforečné, kyselina superfosforečná) zahrnuje sloučeniny obsahující od 72,4 do 88,6 % P 2 O 5 a je to rovnovážný systém sestávající z ortho-, pyro-, tripoly-, tetrapoly- a dalších sloučenin fosforu (viz Kondenzované fosfáty). Když se kyselina superfosforečná zředí vodou, uvolní se. množství tepla a polyfosforečné sloučeniny se rychle mění na ortofosforečné.
H 3 PO 4 lze od ostatních sloučenin fosforu odlišit jeho roztokem s AgNO 3 – vypadává žlutá sraženina Ag 3 PO 4. Zbývající sloučeniny fosforu tvoří bílé sraženiny.
Příjem. Kyselina fosforečná v laboratoři. za podmínek lze snadno získat oxidací fosforu 32% roztokem kyseliny dusičné:
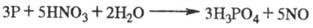
V průmyslu se kyselina fosforečná vyrábí tepelnými a extrakčními metodami.

Tepelný metoda (umožňuje výrobu nejčistší kyseliny fosforečné) zahrnuje zákl. stupně: spalování (oxidace) elementárního fosforu v přebytku vzduchu, hydratace a absorpce vzniklého P 4 O 10 (viz Oxidy fosforu), kondenzace kyseliny fosforečné a shromažďování mlhy z plynné fáze. Existují dva způsoby, jak získat P 4 O 10: oxidace par P (v průmyslu se používá zřídka) a oxidace kapalného P ve formě kapek nebo filmu. Oxidační stav P v ind. podmínky jsou určeny teplotou v oxidační zóně, difúzí složek a dalšími faktory. Druhá fáze získávání term kyselina fosforečná – hydratace P 4 O 10 – se provádí absorpcí téhož (voda) nebo inter-mod. P 4 O 10 pára s vodní párou. Hydratace (P 4 O 10 + 6H 2 O 4H 3 PO 4) probíhá přes fáze tvorby polyfosforových sloučenin. Složení a koncentrace vzniklých produktů závisí na teplotě a parciálním tlaku vodní páry.
Všechny fáze procesu mohou. jsou sloučeny v jednom zařízení, kromě sběru mlhy, který je vždy vyráběn v samostatném zařízení. V průmyslu obvykle používají schémata dvou nebo tří základních. zařízení. V závislosti na principu chlazení plynu existují tři způsoby výroby tepelné energie. kyselina fosforečná: odpařování, cirkulace-odpařování, výměna tepla-odpařování. Odpařte se. systémy založené na odvodu tepla při odpařování vody nebo řed. kyselina fosforečná, max. jednoduchý v hardwarovém designu. Vzhledem k relativně velkému objemu odpadních plynů se však použití takových systémů doporučuje pouze v instalacích s malou jednotkovou kapacitou.
Cirkulovat-odpařovat. systémy umožňují spojit v jednom zařízení stupně spalování P, chlazení plynné fáze cirkulujícího média a hydrataci P 4 O 10. Nevýhodou schématu je potřeba chladit velké objemy tekutiny. Tepelná výměna-vypařovat. systémy kombinují dva způsoby odvodu tepla: stěnou spalovací a chladicí věže a také odpařováním vody z plynné fáze; Významnou výhodou systému je absence cirkulačních okruhů s čerpacím a chladícím zařízením.
Pro domácí účely. podniky využívají technologie. okruhy s cirkulací-odpař. způsob chlazení (dvouvěžový systém). Bude rozlišovat. Vlastnosti schématu: přítomnost add. věže pro chlazení plynu, použití účinných deskových výměníků tepla v cirkulačních okruzích; aplikace je vysoce produktivní. trysky pro spalování P, zajišťující rovnoměrné jemné rozprášení proudu kapaliny P a jeho úplné spálení bez tvorby nižších oxidů.
Technol. instalační schéma s kapacitou 60 tisíc tun za rok 100% H3PO4 znázorněno na Obr. 3. Roztavený žlutý fosfor je rozstřikován ohřátým vzduchem pod tlakem do 700 kPa tryskou ve spalovací věži zavlažované cirkulačním přívodem. Teplo ohřáté ve věži je ochlazováno cirkulující vodou v deskových výměnících tepla. Produktivní obsah obsahující 73-75 % H3PO4, se vypouští z oběhového okruhu do skladu. Kromě toho se v chladicí (hydratační) věži provádí chlazení plynů ze spalovací věže a absorpce sloučenin, což snižuje následné zrození, teplotní zatížení elektrostatického odlučovače a podporuje účinné čištění plynu. Odvod tepla v hydratační věži se provádí cirkulací 50 % H3PO4chlazené v deskových výměnících tepla. Plyny z hydratační věže po odmlžování H3PO4 v deskovém elektrostatickém odlučovači se uvolňují do atmosféry. Na 1 t 100% H3PO4 Spotřebuje se 320 kg P.
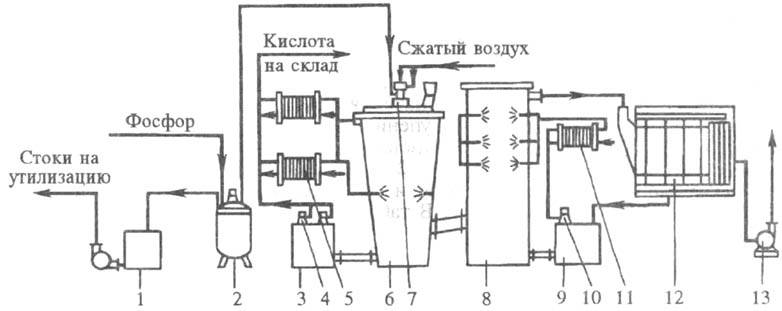
Rýže. 3. Dvouvěžový cirkulační okruh pro výrobu tepla. H3PO4: 1 – sběr kyselé vody; 2 – ukládání fosforu; 3,9 – oběhové kolektory; 4,10 – ponorná čerpadla; 5,11 – deskové výměníky tepla; 6 – spalovací věž; 7 – fosforová tryska; 8 – hydratační věž; 12 – elektrický odlučovač; 13 – ventilátor.
Ekonomičtější extrakční metoda pro výrobu kyseliny fosforečné je založena na rozkladu přírodní. fosforečnany (většinou sírové, v menší míře dusíkaté a mírně chlorovodíkové). Roztoky kyseliny fosforečné získané rozkladem kyseliny dusičné se zpracovávají na komplexní hnojiva a rozkladem kyseliny chlorovodíkové na sraženinu.
Rozklad fosfátových surovin kyselinou sírovou [v zemích SNS Ch. arr. Khibiny apatitový koncentrát (viz Apatit) a Karatau fosfority] – báze. způsob získávání extrakcí kyseliny fosforečné používané pro výrobu konc. fosfor a komplexní hnojiva. Podstatou metody je extrakce (extrakce) P4O10 (obvykle použijte vzorec P2O5) ve tvaru H3PO4. Podle této metody přírodní fosfáty jsou ošetřeny H2SO4 s následným porodem, filtrací výsledné buničiny, aby se oddělila kyselina fosforečná od sraženiny síranu vápenatého. Část vybrané základny. filtrát, stejně jako celý filtrát získaný promytím filtračního koláče, se vrací do extrakčního procesu (ředící roztok), aby byla zajištěna dostatečná pohyblivost buničiny při jejím míchání a přepravě. Hmotnostní poměr mezi kapalnou a pevnou fází je od 1,7:1 do 3,0:1.
Příroda Fosforečnany se rozkládají podle následujícího schématu:
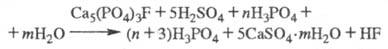
Rozkladu podléhají i související nečistoty: kalcit, dolomit, siderit, nefelin, glaukonit, kaolin a další minerály. To vede ke zvýšení spotřeby použité látky a také snižuje extrakci P2O5 do cílového produktu v důsledku tvorby nerozpustných fosforečnanů železa FeH3(PO4)22,5H2O při koncentracích P2O5 nad 40 % (obsah P4O10 obvykle se uvádí ve smyslu P2O5) a FePO42H2O – při nižších koncentracích. CO se uvolňuje při rozkladu uhličitanů2 tvoří stabilní pěnu v extraktorech; Fosforečnany rozpustné v pH Mg, Fe a Al snižují aktivitu kyseliny fosforečné a také snižují obsah stravitelných forem P2O5 v hnojivech během posl zpracování kyseliny fosforečné.
S přihlédnutím k vlivu nečistot byly stanoveny požadavky na fosfátové suroviny, podle krymské povahy. fosforečnany s vysokým obsahem sloučenin. Fe, Al, Mg, uhličitany a org. jsou nevhodné pro výrobu kyseliny fosforečné.
V závislosti na teplotě a koncentraci kyseliny fosforečné v systému CaSO4-H3PO4-H2O Síran vápenatý se vysráží jako dihydrát (sádra), hemihydrát nebo anhydrit. V reálných podmínkách je sediment kontaminován nečistotami P2O5 v podobě nerozloženého přírodního fosfáty, nemyté H3PO4, kokrystalizované fosfáty rozkl. kovy apod., proto vzniklé Ca sírany se nazývají. resp. fosfosádrovec, fosfohemihydrát a fosfoanhydrit. V závislosti na typu vysráženého síranu existují tři přímé způsoby výroby extrakční kyseliny fosforečné: dihydrát, hemihydrát (hemihydrát) a anhydrit, stejně jako kombinované: hemihydrát-dihydrát a dihydrát-hemihydrát.
V SNS nejvíce V průmyslu byla vyvinuta dihydrátová metoda, která se vyznačuje vysokým výtěžkem P2O5 (93-96,5 %) do výrobního oddělení; relativně nízká koncentrace kyseliny fosforečné však vyžaduje její druhou. vypařování. Základní fáze procesu: extrakce z ext. nebo vnitřní cirkulace a vakuové nebo vzduchové chlazení extrakční buničiny, zrání buničiny po extraktoru, separace kyseliny fosforečné na objemových vakuových filtrech. Účinnost procesu je určena především P extrakce2O5 a filtraci buničiny. Konstrukce hardwaru by měla zajistit úplný rozklad surovin a krystalizaci síranu vápenatého za minimálních podmínek. přesycení kapalné fáze jím. Optim. tvar a velikost krystalů síranu vápenatého určují dobrou filtrovatelnost buničiny a účinné praní od kyseliny fosforečné, min. množství vody (k získání koncentrované produkční kyseliny fosforečné). Typické schéma dihydrátové metody (obr. 4) je realizováno s kontinuálním dávkováním fosfátových surovin, 75-93 % H, do extraktoru2SO4 a obráceně H3PO4. Procesní teplota 72-75 0 C, doba trvání 4-6 hod. Použití 93% H2SO4 (při zpracování apatitového koncentrátu) umožňuje zvýšit přívod vody pro praní fosfosádry na vakuovém filtru. Kyselina fosforečná vstupující do filtru se oddělí, sraženina fosfosádry se na filtru promyje v protiproudém okruhu vodou a výsledná slabá kyselina fosforečná se vrací do extraktoru. Kyselina fosforečná získaná z apatitového koncentrátu (28-32% P2O5), obvykle se odpaří na obsah P2O5 52-54 %. Koncentrace kyseliny fosforečné získané z fosforitů (20-24% P2O5), není možné bez předběžného. čištění od nečistot a v průmyslu se nepoužívá.
Hemihydrátový proces umožňuje získat koncentrovanější kyselina fosforečná (v některých případech až 50 % P2O5 bez přídavku, odpařování). Kyselina fosforečná obsahující 36-38% P2O5, lze získat z apatitového koncentrátu za použití prakticky stejného zařízení jako v typickém dihydrátovém procesu se vzduchem chlazenou buničinou. Karatau fosforitany se touto metodou nezpracovávají. Hemihydrátové procesy se zatím nerozšířily kvůli zvýšené teplotě (80-100 0 C), uvolňování HF do plynné fáze a nižšímu výtěžku P2O5 jiným způsobem než u dihydrátové metody. V vylepšeném průmyslu schémata poskytují předběžné smáčení apatitových surovin ve vysokorychlostním mixéru, separace rozkladných a krystalizačních zón atd. Provádění procesu s obsahem H2SO4 v kapalné fázi buničiny 0,2-1,0 % v prvním reaktoru a 2,0-3,0 % ve druhém umožňuje snížit množství rozpuštěného Ca síranu ve výrobní kyselině fosforečné, výrazně snížit zanášení zařízení a potrubí a výrazně zintenzivnit provoz základního vybavení . technol. uzly
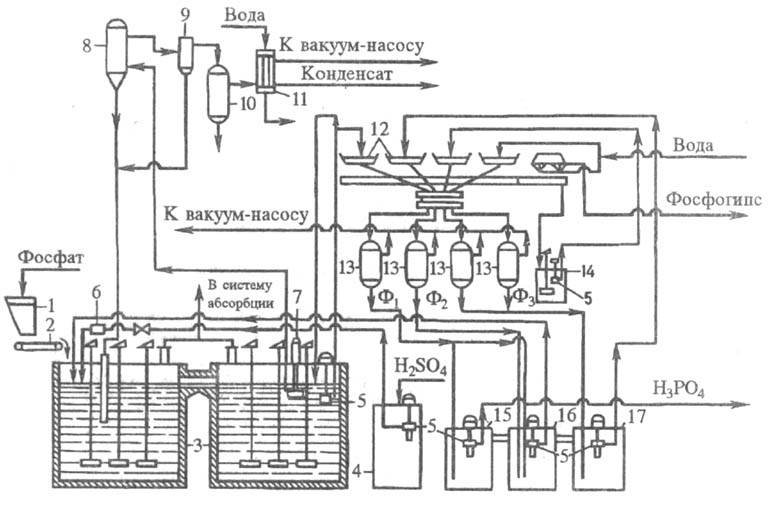
Rýže. 4. Technologické schéma typické výroby těžby H3PO4 v dihydrátovém procesu z apatitového koncentrátu, kapacita 110 tisíc tun P2O5 za rok: 1 – zásobník na fosfátové suroviny; 2 – pásová váha; 3 – dvounádržový odsavač; 4 – sklad síry; 5 – ponorné čerpadlo; 6 – průtokoměr síry; 7 – oběhové ponorné čerpadlo; 8 – výparník; 9 – lapač rozstřiku; 10 – neutralizátor bublin; 11 – kondenzátor; 12 táců karuselového vakuového filtru; 13 – separátory (přijímače); 14 – mezisběr suspenze vzniklé při regeneraci filtrační tkaniny; 15, 16, 17 – barometrické. sběry: pro první (hlavní) filtr (15), pro cirkulační fosfor (16), pro promývací filtrát (17). Obsah P2O5 ve filtrátech: F1 – 28-32 %, F2 – 22-25 %, F3 – 5–10 %
Anhydritová metoda má řadu výhod oproti dihydrátové a hemihydrátové metodě: umožňuje získat roztok obsahující až 50 % P bez odpařování2O5; při extrakci se většina fluoru uvolní do plynné fáze; výsledná směs je méně kontaminována síranem vápenatým. Využití metody v průmyslu brání: silné korozní podmínky (vysoké teploty a koncentrace kyseliny fosforečné), tvorba malých krystalů a potřeba velkého počtu protiproudých pracích stupňů.
Kombinované metody výroby extrakční kyseliny fosforečné – hemihydrát-dihydrát a dihydrát-hemihydrát – jsou technologicky vyspělejší a ekonomičtější než jednostupňové metody. Zajistit zvýšení stupně využití fosfátových surovin (snížením technologických ztrát P2O5), zvýšení koncentrace produkční kyseliny fosforečné, získání čistšího síranu vápenatého pro účely jeho dalšího zpracování.
Hemihydrát-dihydrátová schémata jsou v zahraničí rozšířena a zavedena je i dihydrát-hemihydrátová metoda. Nicméně kombinace procesy jsou někdy komplikovány dvojitou filtrací nebo low-tech z důvodu dlouhé doby trvání rekrystalizačního stupně u hemihydrát-dihydrátové metody (celková doba trvání procesu 10-16 hodin v závislosti na surovině). Z vylepšených kombinací. technologie max. je v zájmu vlasti. dihydrát-hemihydrátový proces s mezifiltrací. Metoda umožňuje získat kyselinu fosforečnou obsahující 33-34 % P z apatitového koncentrátu2O5, z Karatau fosforitů – kyselina fosforečná s obsahem 28-30% P2O5. Míra návratnosti P2O5 ze surovin cca. 99 %. Doba trvání procesu nepřesahuje 6 hod. Fosfohemihydrát (fosfohemihydrát) obsahuje méně než 0,5 % P2O5 a 0,15 % F a m.b. používá se jako pojivo ve stavebnictví. materiálů.
Tepelný kyselina fosforečná se vyrábí z 85-86% (podle P2O5, zbavený nečistot), extrakce – ve formě 40% vodných roztoků (obsahuje mnoho nečistot).
Aplikace. Základní oblast použití kyseliny fosforečné – výroba fosforu a komplexní koncentrace. hnojiva, stejně jako výroba krmných fosfátů, syntetických. detergenty a prostředky na změkčování vody. V kovodělném průmyslu se kyselina fosforečná používá k fosfátování, v textilním průmyslu – ke zpracování a barvení vlny, pěstování. a syntetické vlákna, v org. syntéza – jako katalyzátor. Kyselina fosforečná a její deriváty se také používají pro přípravu vrtných suspenzí při výrobě ropy, při výrobě rozkladu. speciální značky sklo, ve fotografii (pro výrobu fotosenzitivních emulzí), v lékařství (příprava léků, dentálních cementů), ve zpracování dřeva (pro dodání ohnivzdornosti). Deriváty kyseliny fosforečné se používají v potravinách. průmysl – od prášků do pečiva a přípravy tavených sýrů až po výrobu uzenin a výrobu cukru.
Kyselina fosforečná ve vysokých koncentracích způsobuje popáleniny, páry jsou atrofické. procesy v nosní sliznici, krvácení z nosu, drolení zubů, změny krevních hladin atd.; LD50 1,25 g/kg (intragastrické), JIK50 25,5 kg/m 3 (inhalace) – pro myši a potkany.
Lit.: Termální kyselina fosforečná, soli a hnojiva na jejím základě, ed. HH Postníková, M., 1976; Lurie Yu.Yu., Handbook of Analytical Chemistry, 5. vydání, M., 1979; Technologie fosforu, ed. V. A. Ershova, V. N. Belova, Leningrad, 1979; Phosphorus processing, L., 1985; Technologie fosforu a komplexních hnojiv, ed. S. D. Evenchik, A. A. Brodsky, M., 1987; Kyselé metody zpracování fosfátových surovin, M., 1988.
















