Chemické zdroje proudu (CHS) – toto téma má velký praktický význam. Jde o kardiostimulátory, elektromobily, které se snaží chránit životní prostředí, přenosná zařízení včetně foto a video zařízení, počítačové vybavení a navigátory. V posledních letech došlo k velkému pokroku v chemických zdrojích energie, od známých olověných baterií, které jsou postupně nahrazovány lithium-iontovými, lithium-polymerovými a dalšími bateriemi.
V této oblasti se bojuje o výkon, kapacitu, která umožňuje využívat proudové zdroje co nejdéle. Další pobídkou pro jejich rozvoj je vytvoření flexibilních zdrojů proudu. Vědecká složka v této oblasti spočívá ve vývoji materiálů pro takové chemické prvky.
Konstrukce a provoz
Zdroje chemického proudu se skládají z elektrod a elektrolytu, který je umístěn v nádobě. Elektroda, na které dochází k oxidaci redukčního činidla, se nazývá anoda. Elektroda, na které se redukuje oxidační činidlo, se nazývá katoda. Obecně se získá elektrochemický systém.
Náhodným výsledkem této reakce bylo vytvoření proudu. Redukční činidlo přenáší elektrony na oxidační činidlo, které se redukuje. Elektrolyt, který se nachází mezi elektrodami, je potřebný k tomu, aby reakce proběhla. Pokud smícháte prášky různých dvou kovů, elektřina nevznikne, energie se objeví ve formě tepla. Elektrolyt je nezbytný pro zefektivnění procesu pohybu elektronů. Elektrolyt se obvykle skládá z roztoku soli nebo roztavené látky.
Elektrody jsou ve formě kovových mřížek nebo desek. Když jsou umístěny v roztoku elektrolytu, získá se potenciální rozdíl mezi deskami. Anoda elektrony odevzdává a katoda je přijímá. Na povrchu probíhají chemické reakce. Když se okruh otevře, reakce se zastaví. Pokud reagencie dojdou, reakce již také neprobíhá. Pokud vyjmete jednu z elektrod, okruh se otevře.

Z čeho jsou chemické zdroje proudu vyrobeny?
Jako oxidační činidla se používají soli a kyseliny obsahující kyslík, jakož i nitroorganické látky a kyslík. Jako redukční činidla se používají kovy, oxidy a uhlovodíky.
Elektrolyt může obsahovat:
- Soli, zásady a kyseliny rozpuštěné ve vodě.
- Soli v roztoku, s možností elektronické vodivosti.
- Roztavené soli.
- Pevné látky s mobilním iontem.
- Elektrolyty ve formě matrice. Jedná se o kapalné roztoky, taveniny, které se nacházejí v pórech nosiče elektronů.
- Elektrolyty s iontovou výměnou. Pevné látky s pevnými ionogenními skupinami, s jedním znaménkem. S jiným znamením jsou ionty mobilní. Tato charakteristika umožňuje vytvořit unipolární vodivost.

Galvanické články
Napětí na článku je 0,5-4 voltů. Ve vzorcích chemických zdrojů se používá galvanická baterie, která se skládá z prvků. Lze použít paralelní obvod několika prvků. V sériovém obvodu jsou v obvodu zahrnuty identické baterie. Musí mít stejné vlastnosti, stejný design, technologii a standardní velikost. Pro obvod paralelního připojení jsou vhodné prvky s různými vlastnostmi.

Vyučování
Chemické zdroje proudu se dělí podle následujících vlastností:
- Rozměry.
- Strukturální vlastnosti.
- Použité chemikálie.
- Zdroj reakce.
Tyto vlastnosti vytvářejí výkonové parametry pro zdroje, které jsou vhodné pro konkrétní aplikaci.
Rozdělení do tříd elektrochemických zdrojů vychází z rozdílů ve způsobu provozu zařízení. Na základě těchto vlastností se rozlišují:
- Primární zdroje – na jedno použití. Obsahují určitou zásobu látek, které se při reakci spotřebují. Když dojde k výboji, článek vyčerpá svou provozní kapacitu. Primární zdroje založené na chemických reakcích se nazývají prvky. Nejjednodušším prvkem je AA baterie.
- Chemické zdroje proudu, které mají schopnost dobíjet, se nazývají baterie, jedná se o sekundární opakovaně použitelné články. Utracené chemické prvky lze regenerovat a znovu akumulovat energii připojením proudu k nim. Tomu se říká nabíjení článků. Takové články se používají dlouhou dobu, protože se snadno nabíjejí. Během procesu vybíjení vzniká elektrický proud. Mezi takové zdroje patří baterie pro různé typy zařízení a zařízení, jako jsou chytré telefony, notebooky atd.
- Tepelné chemické zdroje proudu – Toto jsou trvalá zařízení. Výsledkem jejich práce je neustálé dodávání nové dávky látek a odstraňování použitého reakčního produktu.
- Smíšené prvky obsahují zásobu činidla. Další činidlo vstupuje do zařízení zvenčí. Doba provozu zařízení závisí na zásobě první látky. Kombinované prvky se používají jako baterie, když je možné regenerovat jejich náboj průchodem proudu z externího napájecího zdroje.
- Chemické zdroje proudu, které se mohou dobíjet, jsou účtovány různými způsoby. Mohou nahradit použité reagencie. Takové zdroje nefungují neustále.
Vlastnosti
Hlavní charakteristiky HIT lze vyjmenovat takto:
- Vybíjecí napětí. Tato vlastnost závisí na konkrétním elektrochemickém systému. Vliv má také procento koncentrace elektrolytu, teplota a proud.
- Napájení.
- Vybíjecí proud v závislosti na odporu obvodu.
- Kapacita, největší množství energie, které zdroj vyprodukuje při totálním vybití.
- Energetická rezerva je největší energie získaná při úplném vybití zařízení.
- Energetické vlastnosti a charakteristiky. U dobíjecích baterií je to počet cyklů nabití a vybití, aniž by došlo ke snížení kapacity a napětí (zdroje).
- Rozsah provozních teplot.
- Doba zdržení je nejdelší přípustná doba od výroby do prvního vybití prvku.
- Doba provozu – nejdelší přípustná doba provozu a skladování. Pro články poháněné palivem jsou důležité provozní doby pro nepřetržitý a periodický provoz.
- Celková energie vydaná za celou dobu práce.
- Mechanická, vibrační pevnost.
- Možnost provozu v jakékoliv poloze.
- Spolehlivý výkon.
- Snadno se čistí.
Cukrová baterie
Pro výrobu lithium-iontových baterií v Japonsku nakupují materiály z jiných zemí. To negativně ovlivňuje ekonomickou situaci země. Vědci proto hledají způsoby, jak vyrobit baterie ze surovin, které jsou k dispozici. Takovou surovinou se v Japonsku stal cukr. Vlastnosti cukrové baterie v Japonsku jsou ve spolehlivosti a energetické náročnosti vyšší než u konvenčních analogů a jejich cena je nižší.
Vysoká poptávka po lithiu způsobená nárůstem přenosných baterií znepokojila výrobce baterií, protože tento prvek se těží pouze v zemích s politickou nestabilitou. To byl druhý faktor při hledání alternativních materiálů pro levné baterie s vysokou spolehlivostí. Sacharóza se snadno přemění na levný materiál pro anodové suroviny v lithium-iontových bateriích.
Cukr se zahřívá ve vakuu pod tlakem až na 1500 stupňů. Promění se v prášek skládající se z uhlíku, který dokáže zvýšit náboj o 20 % více než podobné produkty. To byl první krok ve vývoji levných baterií. Tyto typy baterií zatím nekonkurují moderním bateriím. Vědci však naznačují, že v budoucnu takový vývoj vytlačí drahé produkty.
Požadavky
Konstrukční vlastnosti chemických zdrojů proudu by měly vytvářet podmínky, které by podporovaly maximální účinnost chemických reakcí.
Takové podmínky mohou zahrnovat:
- Zabránění úniku proudu.
- Práce na plný úvazek.
- Těsnost.
- Samostatná reagenční místnost.
- Vysoce kvalitní kontakt elektrolytu s elektrodami.
- Dobrý odvod proudu z objektu chemické reakce na externí výstup s minimálními ztrátami.
Požadavky na chemické prvky jsou:
- Zvýšené hodnoty nemovitosti.
- Maximální rozsah provozních teplot.
- Největší napětí.
- Minimální náklady na elektřinu.
- Konstantní hodnota napětí.
- Dobrá retence nabití.
- Bezpečný provoz.
- Snadná údržba, nebo její nedostatek.
- Dlouhodobá práce.
Provoz proudových zdrojů
Hlavní výhodou primárních prvků je, že nevyžadují žádnou údržbu. Před prací je stačí prohlédnout a určit datum spotřeby. Při zapojení do obvodu nesmí dojít k záměně polarity a poškození kontaktů. Složité návrhy zdrojů vyžadují zvláštní péči. Jeho účelem je maximálně prodloužit životnost.
Péče o baterie vyžaduje následující opatření:
- Zajištění čistoty.
- Sledování parametru napětí odpojeného obvodu.
- Zajištění požadované hladiny elektrolytu přidáním destilované vody.
- Kontrola koncentrace elektrolytu hustoměrem.
Při použití baterií (voltaických článků) musíte dodržovat požadavky, které platí pro používání elektrických spotřebičů.
Rozsah použití
V moderní době se chemické zdroje proudu používají v:
- Doprava.
- Přenosná zařízení.
- Vesmírná technologie.
- Zařízení pro vědecký výzkum.
- Lékařské přístroje.
Používá se v domácí sféře:
- Baterie (suché).
- Elektronické baterie.
- Baterie do aut.
Lithiové chemické zdroje energie jsou široce používány. To je způsobeno tím, že lithium má maximální specifickou energii. Má nejvíce záporný elektrodový potenciál ze všech kovů. Lithium-iontové baterie předčily všechny ostatní zdroje, pokud jde o hodnoty hustoty energie. Vědci v současné době vyvíjejí různá vylepšení lithiových baterií. Vývoj probíhá směrem k získání ultratenkých designů krytu, které budou použity k napájení smartphonů a podobných gadgetů, a také k vytvoření ultravýkonných baterií.
V poslední době vědci provádějí seriózní práci na vynálezu a modernizaci palivových baterií – zařízení, která vytvářejí elektrickou energii prováděním chemických reakcí látek, které jsou neustále přiváděny k elektrodám zvenčí. Berou kyslík pro oxidaci a snaží se využít vodík jako palivo. Některé prototypy již na bázi takových baterií v elektrárnách fungují.

Již více než dvě století lidstvo využívá energii chemických reakcí mezi různými látkami k výrobě stejnosměrného proudu.
Princip činnosti
Redoxní reakce, ke které dochází mezi látkami, které mají vlastnosti oxidačního činidla a redukčního činidla, je doprovázena uvolňováním elektronů, jejichž pohyb tvoří elektrický proud. Pro využití jeho energie je však nutné vytvořit podmínky pro průchod elektronů vnějším obvodem, jinak se do vnějšího prostředí uvolňuje teplem při pouhém smíchání oxidačního činidla a redukčního činidla.
Proto všechny chemické zdroje proudu mají dvě elektrody:
anoda, kde dochází k oxidaci;
katoda, která provádí redukci látky.
Elektrody jsou umístěny na dálku v nádobě s elektrolytem – látkou, která vede elektrický proud v důsledku procesů disociace média na ionty.
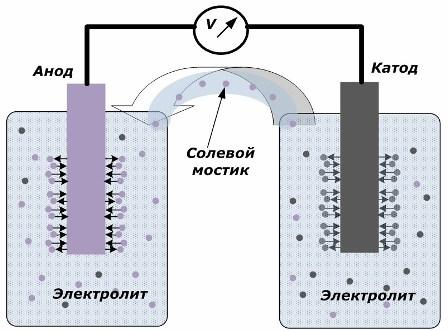
Princip přeměny chemické energie na elektrickou energii
Obrázek ukazuje, že elektrody jsou umístěny v samostatných nádobách spojených solným můstkem, přes který je vytvářen pohyb iontů po vnitřním okruhu. Při otevřeném vnějším a vnitřním okruhu probíhají na elektrodách dva procesy: přechod iontů z kovu elektrody na elektrolyt a přechod iontů z elektrolytu do krystalové mřížky elektrod.
Rychlosti těchto procesů jsou stejné a na každé elektrodě se hromadí napěťové potenciály opačných znamének. Pokud jsou spojeny přes solný můstek a je přivedena zátěž, vznikne elektrický obvod. Podél vnitřního obvodu vzniká pohybem iontů mezi elektrodami přes elektrolyt a solný můstek elektrický proud. Vnějším obvodem se elektrony pohybují ve směru od anody ke katodě.
Téměř všechny redoxní reakce jsou doprovázeny výrobou elektřiny. Jeho hodnota však závisí na mnoha faktorech, včetně objemů a hmotností použitých chemikálií, materiálů používaných pro výrobu elektrod, typu elektrolytu, koncentrace iontů a designu.
Největší aplikace v moderních chemických zdrojích energie jsou:
pro materiál anody (redukční činidlo) – zinek (Zn), olovo (Pb), kadmium (Cd) a některé další kovy;
pro katodový materiál (oxidátor) – oxid olovnatý PbO2, oxid manganu MnO2, hydroxid niklu NiOOH a další;
elektrolyty na bázi roztoků kyselin, zásad nebo solí.
Klasifikační metody
Některé z chemických zdrojů proudu lze znovu použít, jiné nikoli. Tento princip je brán jako základ pro jejich klasifikaci.
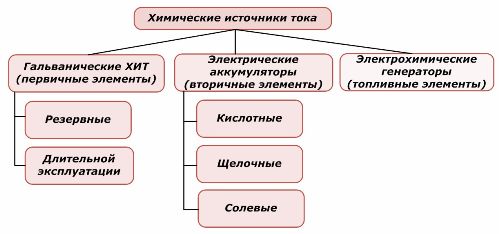
Klasifikace chemických prvků
Elektromotorická síla galvanických článků v závislosti na provedení dosahuje 1,2÷1,5 voltu. Pro získání větších hodnot se spojují do baterií, zapojených do série. Při paralelním zapojení baterií se zvyšuje proud a výkon.
Obecně se uznává, že primární chemické zdroje proudu nepodporují dobíjení, i když přesněji lze tento postoj formulovat jinak: jeho implementace není ekonomicky proveditelná.
Záložní primární chemické zdroje proudu jsou uloženy ve stavu, kdy je elektrolyt izolován od elektrod. Tím se eliminuje vznik redoxní reakce a je zajištěna připravenost k uvedení do provozu. Nejsou znovu použity. Skladovatelnost záložních chemických zdrojů energie je omezena na 10–15 let.
Baterie se úspěšně dobíjejí přivedením externí elektrické energie. Díky této vlastnosti se jim říká sekundární zdroje proudu. Jsou schopny vydržet stovky a tisíce cyklů nabití a vybití. EMF baterie může být v rozmezí 1,0÷1,5 voltu. Jsou také kombinovány do baterií.
Elektrochemické generátory fungují na principu galvanických článků, ale pro provedení elektrochemické reakce jsou látky přiváděny zvenčí a všechny uvolněné produkty jsou z elektrolytu odstraněny. To umožňuje nepřetržitý proces.
Základní výkonové charakteristiky chemických zdrojů energie
1. Hodnota napětí na otevřených svorkách
V závislosti na konstrukci může jediný zdroj vytvořit pouze určitý potenciální rozdíl. Pro použití v elektrických zařízeních jsou kombinovány do baterií.
2. Měrná kapacita
Po určitou dobu (v hodinách) může jeden chemický zdroj proudu produkovat omezené množství proudu (v ampérech), které se vztahuje k jednotce hmotnosti nebo objemu.
3. Hustota výkonu
Charakterizuje schopnost jednotky hmotnosti nebo objemu zdroje chemického proudu generovat energii generovanou součinem napětí a proudu.
4. Doba provozu
Tento parametr se také nazývá datum expirace.
5. Hodnota samovybíjecích proudů
Tyto vedlejší procesy elektrochemických reakcí vedou ke spotřebě aktivní hmoty prvků, způsobují korozi a snižují měrnou kapacitu.
6. Cena produktu
Záleží na provedení, použitých materiálech a řadě dalších faktorů.
Za nejlepší chemické zdroje proudu jsou považovány ty, které mají vysoké hodnoty prvních čtyř parametrů a nízké samovybíjení a náklady.
Principy nabíjení baterií
Mezi sekundárními chemickými zdroji proudu získávají velkou oblibu lithium-iontové modely, které se široce používají pro napájení elektronických zařízení. Jako materiál kladné elektrody používají LiMO2 (M Co, Ni, Mn) a jako materiál záporné elektrody grafit.
Při nabíjení se ionty lithia z aplikované vnější energie uvolňují z katodového kovu, procházejí elektrolytem a pronikají do prostoru mezi vrstvami grafitu, kde se hromadí.
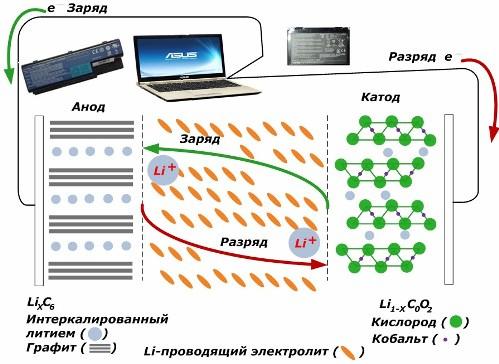
Když z nabíječky nevychází žádná energie a k elektrodám je připojena zátěž, ionty lithia v elektrolytu se pohybují opačným směrem.
Pokud se nabíjení a vybíjení neprovádí, energie v baterii se nespotřebovává, ale ukládá. Jeho množství je ale limitováno vlastnostmi použitých materiálů. Například pro lithium-iontové baterie je specifická elektrická kapacita 130÷150 mAh/g. Je omezena vlastnostmi materiálu anody. U grafitu je kapacita přibližně dvojnásobná.
Vědci nyní hledají způsoby, jak zvýšit kapacitu baterie a zkoumají možnost využití chemické reakce mezi lithiem a vzdušným kyslíkem. Pro tento účel jsou vyvíjeny konstrukce se vzduchovou, nekonzumovatelnou katodou, používanou v jednotlivých bateriích. Tato metoda může zvýšit hustotu energie až 10krát.
Provoz chemických zdrojů proudu vyžaduje znalost základů elektrotechniky, elektrochemie, nauky o materiálech a fyziky pevných látek.
Doufám, že vám tento článek pomohl. Podívejte se také na další články z kategorie Elektrická energie doma a v práci » Pomoc začínajícím elektrikářům

















